核酸四面体技术治疗眼科疾病
2024-06-07
全球独创框架核酸药物递送体系在针对视网膜新生血管疾病难题的研究上,顺利完成机制研究、细胞药学验证和非临床动物模型验证,取得了颠覆性成果。该递送体系由IADR中国内地首位获奖者林云锋教授团队研发,云海生物罗德伦教授团队进行产业开发。
20多年前,当云海生物的创始人之一林云锋教授还是一名刚刚进入医学科研的医生时,在樊春海院士的引荐下,他第一次接触到了框架核酸,并深耕研发全新药物递送体系以及核酸药物研究的实践;2015年,当林云锋教授遇到了中国最具含金量眼科创新生物制品“康柏西普”的总项目负责人罗德伦教授,双方在激烈的讨论后,框架核酸从被质疑、验证、再发现,最终“碱基互补”般诞生了“云海生物”。这恰好是“让更多患者受益”,也正是一名医学从业者坚持科研的意义。日前,云海生物向全球分享人类主要的致盲性眼病:视网膜新生血管病变的突破性研究发现。
视网膜新生血管病变是全世界数百万患者不可逆视力损害和失明的主要病因,包括早产儿视网膜病变(ROP),增殖性糖尿病视网膜病变(PDR)、视网膜静脉闭塞(RVO)等多种致盲性视网膜疾病。目前治疗手段有抗血管内皮生长因子(VEGF)药物和视网膜激光光凝术,但均存在明显的缺点,如抑制VEGF信号转导可能影响正常视网膜血管的生长,激光导致视网膜组织损伤引起并发症等。此外,缺血、缺氧会进一步造成视网膜神经细胞的不可逆损伤,截止目前,仍然缺少安全有效的神经细胞保护方法。因此,迫切需要优化视网膜新生血管病变的治疗策略。
“如果把眼睛比喻成为照相机,目前全球眼科难以攻克的失明原因已经从传统影响镜头透光和投射变焦的‘光路疾病’转变为影响成像和传输的‘视路疾病’。“视路”的第一站是视网膜,人类的视网膜是由数亿个感光细胞组成的最精细的感光和视觉处理系统,通过视神经和大脑相连。由于视网膜中存在丰富的血管网以及大量不可再生的神经细胞,一旦受到损伤,会直接导致视觉的损伤甚至完全丧失视觉。各种原因导致视网膜病变的疾病已经成为人类主要的致盲性眼病,例如老年性黄斑变性、遗传性视网膜变性、糖尿病性视网膜病变等。
此前在中山眼科眼底病中心做了多年临床医疗主任的丁小燕教授对患者无药可医的无奈深有感触。在眼底病门诊,每当有病人问她:“医生,我会瞎吗?”她也只能去安慰道:“不会的,医疗技术一直在突破,一定有机会的。”
全球眼科诊疗器械和药物创新技术不断爆发,一系列新技术和新药物陆续出现,玻璃体切除设备、白内障超声乳化设备、各种激光诊断和治疗设备、前列腺素类抗青光眼药物、抗血管内皮生长因子药物……更重要的是,中国几乎同步了每一项技术的突破,不仅使得数以万计的患者有了重获光明的机会,也鼓舞了中国眼科医学的研究向深水区进军。
在科研研发和产业开发面前,所有的准备永远都是不够,唯一可以准备的可能就是“坚持”。
视网膜RIR大鼠模型中,实验药物 3 个剂量组 RGCs 数量显著增多,且差异具有统计学意义,可较好治疗由于缺血再灌注导致的RGCs 数量减少,且呈现较好的量效关系
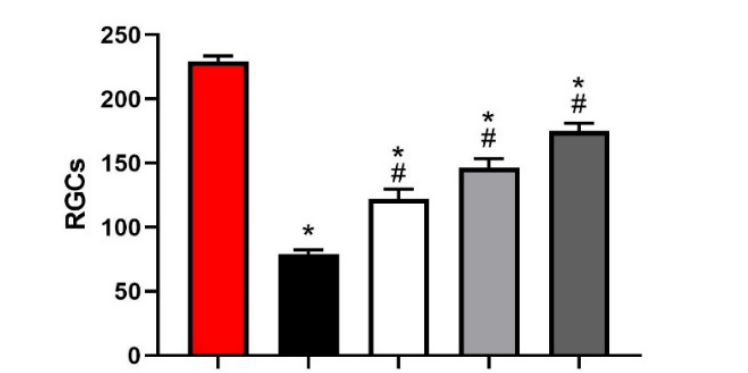
图1:视网膜神经节细胞计数
左往右依次为:正常组,阴性对照组,实验药物低浓度组,实验药物中浓度组,实验药物高浓度组。
事实上,视网膜OIR小鼠模型显示出实验药物不仅可以抑制病理性新生血管的面积(图2),而且可以促进血管闭塞区域的生理血管发育(图3)。因此,实验药物不仅可以减轻异常血管生长,还可以通过减少血管闭塞来帮助恢复缺血视网膜的正常血管系统。这项研究强调了实验药物作为缺血性视网膜疾病治疗选择的创新潜力,缺血性视网膜疾病是世界范围内发达国家和发展中国家失明的主要原因。
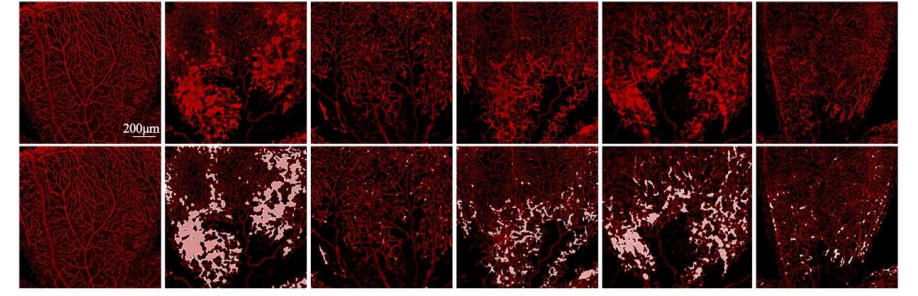
图2:视网膜新生血管面积
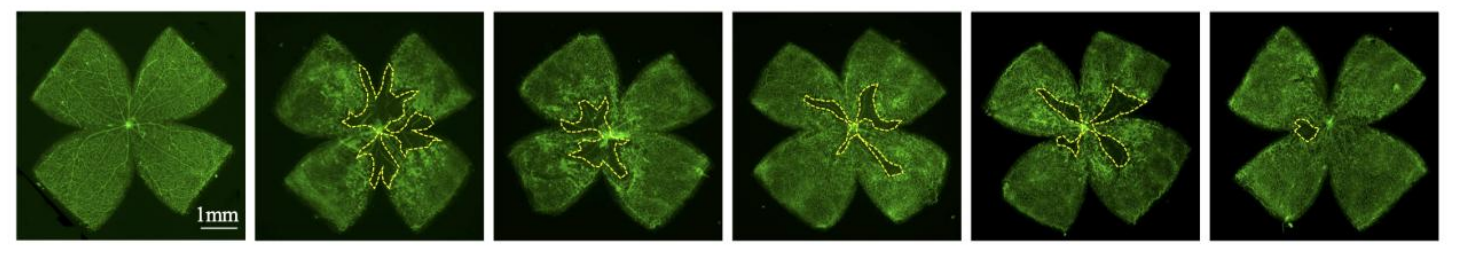
图3:视网膜血管闭塞面积
从左往右依次为:正常组,阴性对照组,阳性对照组,药物1组,药物2组,实验药物组。
在云海生物看来,每一个从事医学科研和产业开发的人们内心必定一个理想,也正是这种理想的感召让他们能够坚持在残酷的创业路上披荆斩棘。云海生物每一步成长,必定在各类上下游资源的支持下,在一群人的努力下绽放,期待框架核酸递送体系(tFNA)在针对视网膜病变临床难题上的下一步突破。


