一种反义肽核酸-DNA四面体载体复合物及其制备方法和应用
2024-06-26
背景:
耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)是临床上常见的毒性较强的细菌,其具有不均一耐药性,以及广谱耐药性,是一种临床上常见的感染病菌。这类菌株所导致的临床感染治疗失败率较高,被称作“超级细菌”。在目前的研究中,治疗MRSA感染的药物的靶标多是一些常见的细胞因子,如黏附性因子,影响细胞壁合成因子等,采用这类靶标的药物特点是,容易使其产生耐药性,所以需要从新的角度选择药物作用靶点。另外,反义肽核酸(asPNA)作为一种不带电荷的DNA类似物,无法像核酸一样通过内吞作用进入细胞,所以必须借助载体运输。而当前研究中常用的载体为细胞穿膜肽,该类载体在通常在革兰氏阴性菌中穿膜效果好,而在革兰氏阳性菌中效果略差,且存在较强的细胞毒性,会影响正常的动物细胞的生物学行为。因此,当前迫切需要从新的角度选择多重耐药菌的抗菌作用靶点,并实现药物向靶点的精准递送。
前沿科研成果:能有效抑制MRSA生长的反义肽核酸-DNA四面体载药复合物
反义肽核酸(PNA)是一种人工合成的DNA类似物,可根据碱基互补配对原则特异性的抑制基因的表达。由于其为电中性,且不存在磷酸基团,所以不存在电性相斥的现象,导致与DNA/RNA结合能力更强,不被核酸酶和蛋白酶水解,从而避免了天然DNA和RNA寡核苷酸作为靶向探针可能导致许多脱靶效应的现象
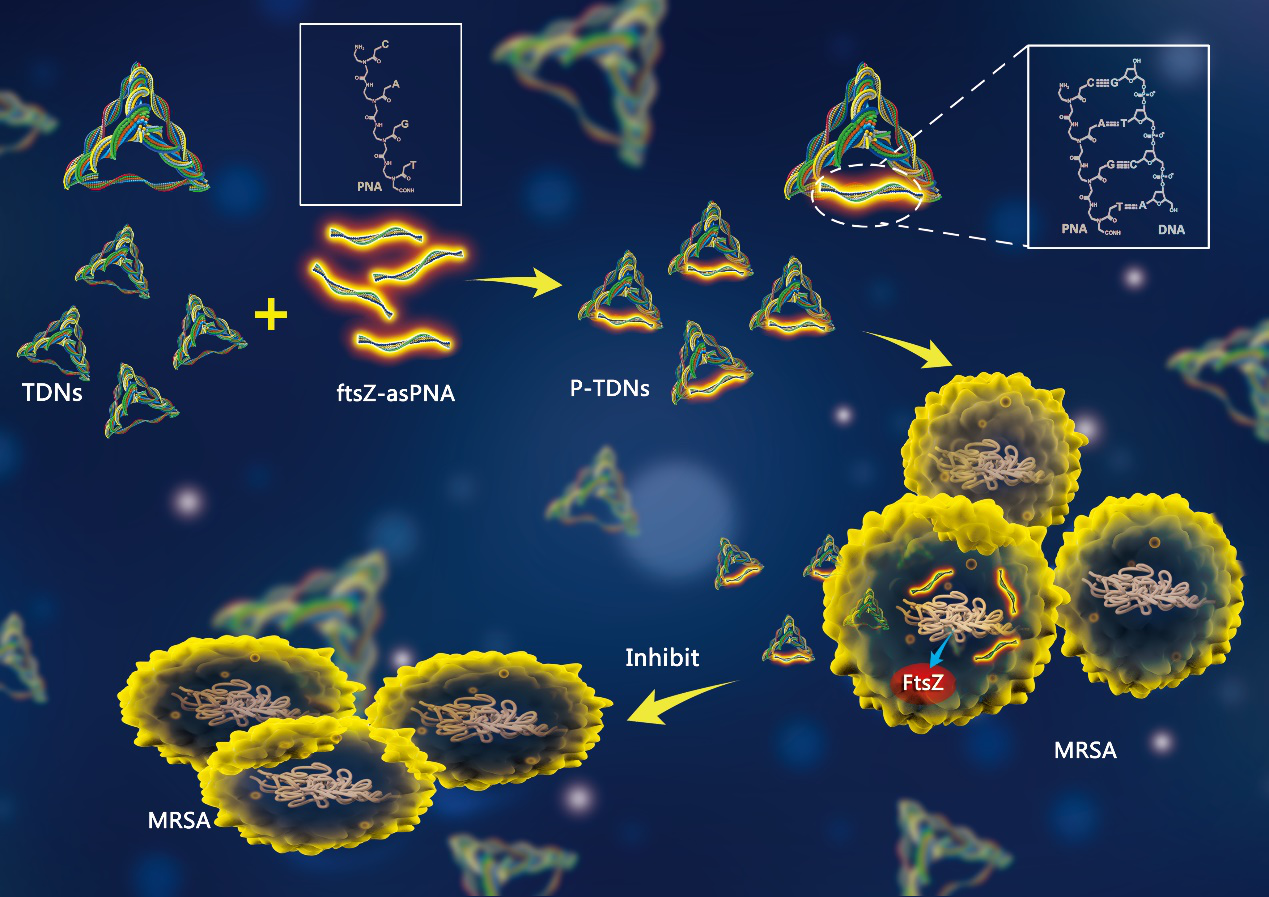
在TDN优良性能的基础上,我们的技术团队对其进行了功能和结构上的升级,不仅优化了其作为载体的性能,结构上,在不影响功能的前提下,保留了TDN和反义肽核酸的原有优良性质。使TDN作为一种新型的PNA穿膜载体。解决了目前反义肽核酸的应用中所面临的;未经修饰的肽核酸摄取障碍,常用反义肽核酸载体—细胞穿膜肽无特异性且存在细胞毒性的问题。
在功能上,P-TDN是一种针对全新的细菌靶位并且与传统抗菌药物具有完全不同的抗菌机制的新型抗菌药物。我们技术团队选择了存在于几乎所有原核生物中的细胞分裂关键蛋白FtsZ作为目标靶点,由于其在细菌中高度保守,因此不仅能够实现抑制多重耐药菌的生长,还具有广谱抑菌的应用潜能。而高度耐药菌MRSA对DNA四面体的成功摄取,为进一步采用TDN携带抗生素以增效抗菌,以及携带反义耐药基因序列从而逆转耐药提供了可行性。
基于以上所述,我们的技术团队构建了内载反义肽核酸的tFNA复合物P-TDNs,以抑制多重耐药菌的生长。通过碱基互补配对原则将FtsZ的反义肽核酸搭载在tFNA的侧链上,既保留了TDNs空间结构及自身特性,同时利用PNA难以降解的功能特性,有助于其在细菌内的有效释放,使P-TDN能达到理想的抗菌作用。
研究方法:
采用AFM、TEM、和PAGE等方法鉴定P-TDNs的合成;使用粒径、ZETA电位检测确定反义肽核酸的成功搭载。共聚焦显微镜和流式细胞术检测P-TDNs进入多重耐药菌的能力;通过抗菌活性测定实验、细菌生长曲线测定实验检测P-TDNs对MRSA生长的抑制作用;qPCR检测P-TDNs对MRSA对FtsZ基因的沉默作用。
实验结果:
技术团队成功合成了复合物P-TDNs。并证明了P-TDNs可携带PNA并被多重耐药菌成功摄取。证明了P-TDNs能够靶向抑制细菌的分裂关键蛋白FtsZ的表达,从而抑制多重耐药菌在对数生长期的快速分裂。证明了P-TDNs具有良好的抗菌活性。
研究结论:
我们的技术团队成功地构建了一种用于递送反义肽核酸的框架核酸递送系统,并证明了P-TDNs能被非感受态细菌成功吸收。通过靶向抑制细菌的分裂关键蛋白FtsZ的表达,从而影响细菌的对数生长期,最重实现有效抑制多重耐药菌MRSA的生长。
发表文献:Nano Letters 2018, 18, 9, IF 10.8 , DOI: 10.1021/acs.nanolett.8b02166