一种嵌入式搭载siRNA的四面体框架核酸及其用途
2024-08-15
四面体框架核酸(tFNA)作为药物纳米载体,由于其优异的细胞摄取性能而受到广泛关注。然而,对于寡核苷酸货物,tFNA 主要作为一个静态传递平台,通过粘连产生。在这里,灵感来自原来的稳定空间内的四面体支架,一个动态溶酶体激活的 tFNA 纳米盒制造完全封装短干扰 RNA (siRNA)的兴趣。封闭的四面体结构赋予货物 siRNA 对 RNA 酶和血清具有更大的抗性,并使其能够在交付过程中与载体实体整合。此外,纳米盒的 pH 响应开关可以控制 siRNA 在细胞培养温度下进入溶酶体时的释放。在保护性加载和主动卸载的基础上,通过体外和肿瘤坏死因子-α 实验,获得了对靶基因 α (TNFα)的良好沉默活体内。总之,该纳米盒为 siRNA 提供了一个动态 pH 敏感的限制传递系统,并且可以作为其他小 RNA 的扩展策略。
背景:
短干扰RNA(short interfering RNA,siRNA)是一种长度约20-25个碱基对的双链RNA分子,能够与特定基因的mRNA互补结合,从而激发其降解,阻止该基因表达。siRNA具有特异性强、快速高效的优势,与蛋白质类药物相比可编辑性更强、设计更加简便,在近年来受到了大量学者的关注。然而,目前绝大对数的siRNA药物仍面临递送效率的难题,包括无法入胞,酶降解,溶酶体逃逸失败等问题。即使目前少有几款siRNA药物已批准上市,但距离广泛的临床应用还有研究空间。因此,针对siRNA递送中的具体瓶颈开发药物载体,彻底解决技术壁垒对于实现siRNA药物在临床中的广泛应用具有重要意义。
前沿科研成果:一种嵌入式搭载siRNA的四面体框架核酸及其用途
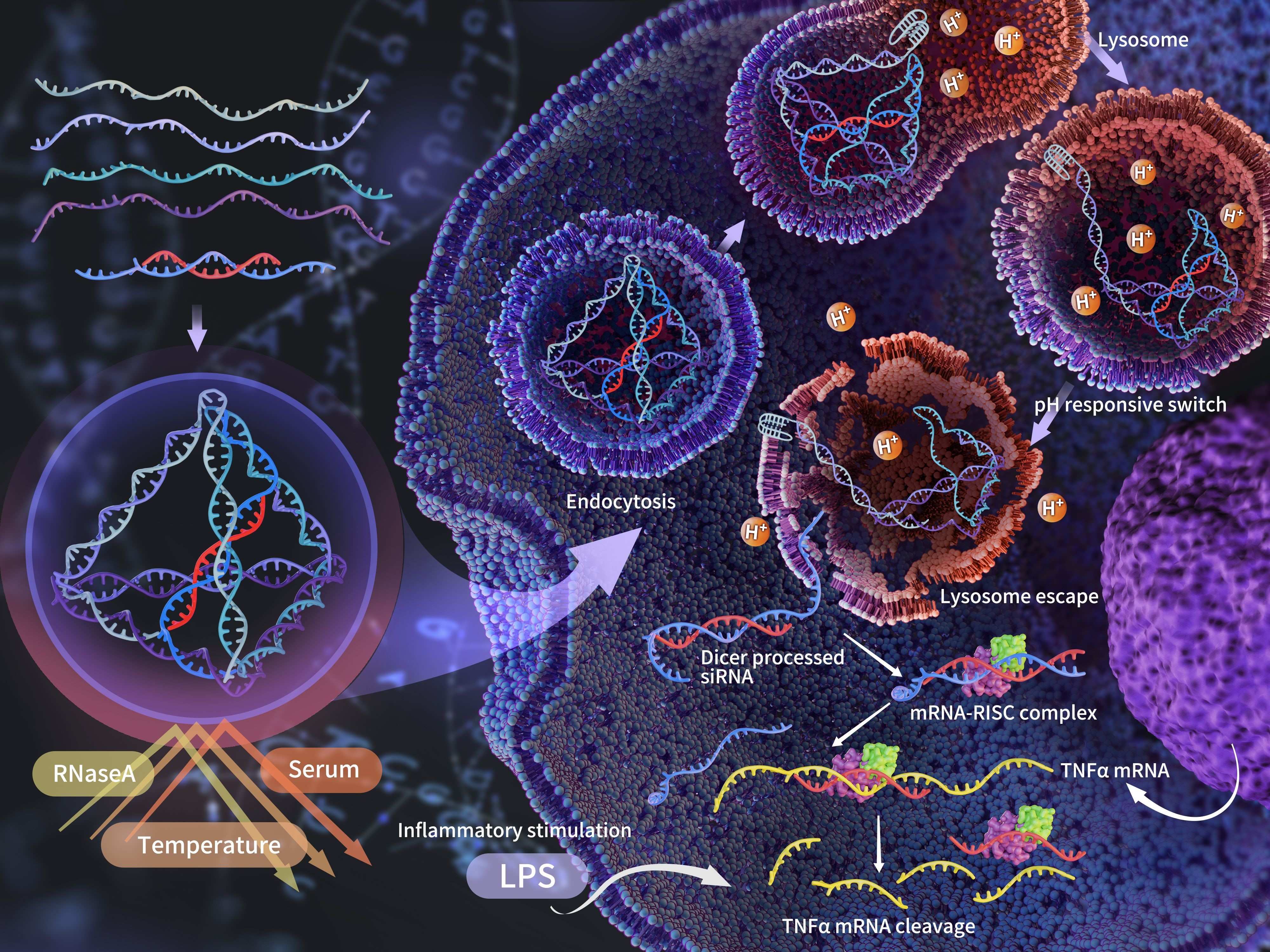
四面体框架核酸是一种具有四面体构象的三维DNA纳米材料。由于其良好的入胞能力、生物相容性、可编辑性、尺寸可控性等优势。目前在分子运输,疾病诊断,生物成像等领域都有大量的研究。因为化学本质相同,四面体框架核酸在核酸类药物,比如DNA、RNA药物的递送上展现出独特的优势和效果。回顾前期研究,我们发现,tFNA搭载RNA的常规方式包括镶嵌式、顶点式和悬臂式,这些搭载方式虽然便于修饰,但是tFNA主要起到载体的递送作用,而保护作用较弱、缺乏对RNA的控释,而且连接RNA药物的稳定性较差。
因此,通过分析四面体框架核酸的理化特征,我们的技术团队利用其内部的固有空间研发一种纳米盒(Nanobox),用于包裹和递送siRNA。一方面,利用嵌入载体内的方式,实现对目标siRNA的保护性搭载;另一方面,利用pH响应性开关,使siRNA在胞内可以得到可控性释放。
研究方法:
采用AFM、TEM和PAGE等方法鉴定Nanobox@siR的合成和稳定性;流式细胞术、共聚焦显微镜和小RNA qPCR检测分析Nanobox@siR进入巨噬细胞的生物学行为进行追踪;qPCR、ELISA等检测手段分析Nanobox@siR在脂多糖诱导炎症状态的巨噬细胞内抑制TNF-α、IL-6、IL-1β等炎症因子表达的能力。小动物活体成像分析Nanobox@siR经腹腔注射后的体内代谢情况。动物实验检测Nanobox@siR对全身炎症小鼠体内TNF-α表达水平的抑制作用及抗炎效果。
实验结果:
技术团队成功完成了Nanobox搭载siRNA的设计和合成,Nanobox@siR能够显著提高siRNA的抗酶降解及抗血清降解能力,实现稳定搭载,仅在37℃及pH为5的酸性条件下释放目的siRNA。Nanobox递送的siRNA能够穿过细胞膜及溶酶体屏障,最终在胞质内经酶剪切为成熟siRNA。入胞速度及均质性优于Lipofectamine 3000 转染和单个黏性末端搭载的siRNA载体。Nanobox递送的siRNA能够有效沉默巨噬细胞内TNF-α表达,并降低其他相关炎症因子水平。在体内外实验中都表现出显著的抗炎效果。
研究结论:
我们的技术团队通过创新的嵌入式搭载方式以及pH响应性开关构建了一种新型的动态siRNA载体,具有保护性递送和可控性释放的特点,并且合成简便、高效。Nanobox包裹siRNA后未影响原本的四面体构型,因此保留了tFNA优异的入胞优势,使siRNA入胞后完成溶酶体逃逸,最终能够进入胞质内发挥作用。Nanobox递送的siRNA能够高效地沉默TNF-α表达,进而抑制炎症发展。与Lipofectamine 3000转染相比,具有快速、高效、均质的优点。本研究设计的Nanobox为siRNA递送构建了一种普适性的平台,通过修饰连接端,可以搭载任意siRNA序列,具有广阔的应用前景。
发表文献:Advance Materials 2022:2201731,IF=29.4 DOI: 10.1002/adma.202201731
![]() A Lysosome-Activated Tetrahedral Nanobox for Encapsulated siRNA Delivery.pdf
A Lysosome-Activated Tetrahedral Nanobox for Encapsulated siRNA Delivery.pdf