一种用于骨髓损伤和/或抑制的复合物
2024-06-26
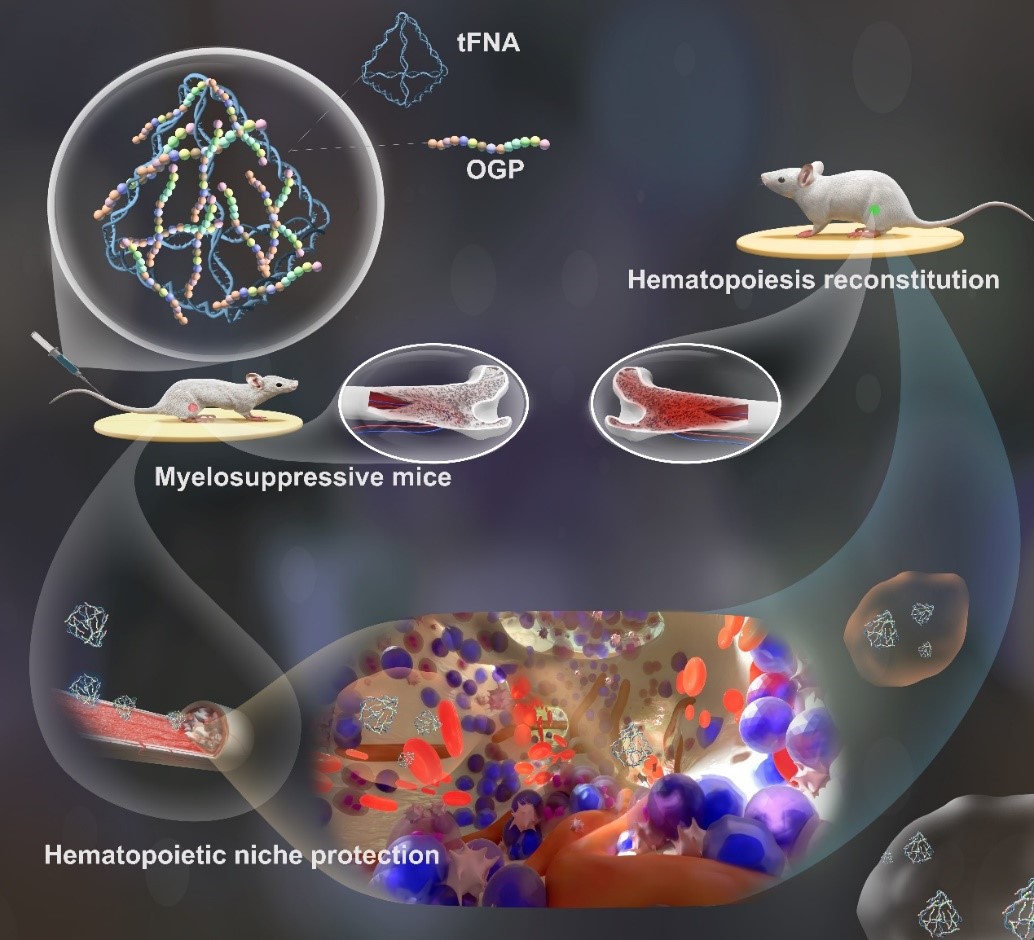
本发明公开了一种用于骨髓损伤和/或抑制的复合物,所述复合物是由DNA四面体与成骨多肽复合而成;所述DNA四面体是由单链DNA通过碱基互补配对自组装形成的四面体结构。本发明通过特定的核苷酸序列制得的DNA四面体框架纳米核酸与成骨生长肽在特定浓度条件下复合,在预防和/或治疗骨髓损伤及造血抑制方面效果显著,经细胞实验和动物实验证明,本发明成骨生长肽-DNA四面体框架纳米核酸复合物能显著提高骨髓基质细胞活性,促进骨髓基质细胞增殖,缓解骨髓基质细胞的凋亡, 促进骨髓造血相关因子的分泌。本发明的多肽-纳米核酸符合物生物安全性好,副作用小,相比于生长因子类药物,不会增加放化疗肿瘤复发的风险,用于骨髓抑制的预防及治疗,应用前景良好。
背景:
近年来,肿瘤的发病率持续增高且呈年轻化趋势,而肿瘤放化疗可能会引起局部或全身的骨髓抑制作用,导致患者的免疫力低下,继发机体感染甚至多器官衰竭。同时,骨髓抑制可能会影响骨的再生与重建,出现骨骼营养障碍,显著降低新骨形成,进而可能影响拔牙窝的愈合及种植体的骨结合等。目前对于骨髓抑制的治疗主要是应用特异性的细胞生长因子等进行针对性处理,如粒细胞集落刺激因子等,但其缺点是不能平衡的引起多细胞系的反应,需要多种生长因子共同作用才能全面恢复患者的造血及免疫功能,且生长因子的应用可能导致肿瘤进程的加快以及复发等问题。因此,亟需开发更为安全且高效的药物递送策略用于化疗患者骨髓的保护,降低化疗损伤的副作用,改善化疗患者骨髓的造血、免疫及成骨能力。
前沿科研成果:具有缓解化疗导致的骨髓抑制及实现骨髓保护的成骨生长肽-四面体框架核酸复合物
成骨生长肽(Osteogenic Growth Peptide,OGP)是一种对骨髓损伤有系统性应答的因子,其生物学作用包括提高成骨能力、改善骨髓微环境以及促进造血功能等,有广泛的生物医学应用前景,但其体内生物利用度较低,且多肽类药物的体内递送效率仍亟待提高。
DNA四面体框架核酸(Tetrahedral Framework Nucleic Acids,tFNAs)是由4条单链自组装而形成的纳米框架结构,在组织再生及药物载体方面有较大的应用潜力。tFNAs已被证实可促进细胞的增殖迁移,同时具有良好的入胞潜能,可作为载体进行miRNA、siRNA以及其它小分子药物等的递送,但其仍存在一定局限性,如溶酶体降解、体内清除速率快等。为解决多肽及核酸类药物的局限性,可将多肽及核酸材料结合,构建新型的纳米材料及生物递药系统,以提高材料稳定性,延长体内循环时间,提高药物的整体递送效率,是目前生物医学领域的研究热点。
基于以上所述,我们的技术团队将OGP与tFNAs结合形成多肽-核酸复合纳米递药系统,既发挥四面体框架核酸的载体作用,提高OGP的递送效率,又可提高tFNAs系统性给药后的稳定性,减缓tFNAs的体内清除速率,同时结合二者的多重生物学效应,用于缓解化疗药物所致骨髓抑制,实现化疗骨髓保护。
研究方法:
采用AFM、PAGE、粒径电位测定等方法鉴定OGP-tFNAs的合成并进行表征;共聚焦显微镜和流式细胞术检测OGP-tFNAs进入骨髓基质细胞的能力;流式细胞术、WB等检测骨髓基质细胞凋亡情况及骨髓造血相关因子的表达情况。动物实验小鼠化疗骨髓抑制模型验证OGP-tFNAs复合物的化疗骨髓保护作用。
实验结果:
技术团队成功合成了复合物OGP-tFNA。OGP-tFNA可被骨髓基质细胞大量摄取,能有效抑制因化疗药物导致的的骨髓基质细胞凋亡,促进SDF-1、SCF、Ki67等生长因子的表达。其在体内也发挥了骨髓保护的功能,保护骨髓中干细胞的生理功能,维持骨髓中生长因子的表达,有效缓解化疗引起的骨髓抑制。
研究结论:
我们的技术团队成功地构建了一种用于缓解化疗骨髓抑制及损伤的OGP-tFNAs递送系统,在体内外实验中,OGP-tFNAs均可不同程度地保护骨髓基质细胞,减少骨髓细胞的凋亡,维持造血相关因子的表达水平,从而缓解化疗导致的骨髓抑制。现有研究结果表明,该OGP-tFNAs纳米框架核酸复合物在骨髓保护及造血方面有较大的应用前景,展示了多肽与核酸纳米材料复合递药系统在生物递药方面的潜力。
发表文献:Adv Sci . 2022 Sep;9(27):e2202058 ,IF=15 DOI:10.1002/advs.202202058