DNA四面体框架核酸-绿原酸复合物及其在制备治疗肝纤维化的药物中的用途
2024-07-02
本发明提供了一种DNA四面体框架核酸和绿原酸复合而成的复合物,以及上述复合物在制备治疗肝纤维化和/或器官损伤的药物中的新用途。本发明复合物能够有效抑制体外肝星状细胞的激活,减轻CCl4诱导的肝纤维化,并可通过减轻机体的氧化应激水平,增加抗氧化酶的生成,从而有效减轻CCl4诱导的肝脏、脾脏、肾脏和肺的器官损伤。DNA四面体框架核酸与绿原酸发挥协同增效作用,具有很好的应用前景。
背景:
肝硬化是一种广泛存在的慢性进展性肝病,表现为明显的肝脏形态和功能异常,可导致严重的全身并发症。据不完全统计,全球每年约有 200 万人死于肝病,其中超过 50% 的死亡与肝硬化及其并发症有关。晚期肝硬化病变只能通过肝移植来部分弥补肝功能,因此,早期阻断肝硬化的进展是目前最有效的治疗方法。肝纤维化是肝硬化的早期阶段,是慢性损伤引起的持续性异常组织修复。在肝纤维化的进展过程中,肝星状细胞(HSC)的活化是一个重要因素,肝脏中约80%的胶原蛋白I来源于活化的HSCs。当肝脏受到持续性损伤时,静止的造血干细胞会转化为肌成纤维细胞,并移动到损伤部位分泌细胞外基质,从而形成纤维瘢痕。然而,目前还没有抗肝纤维化药物获得美国食品和药物管理局或欧洲药品管理局的许可。肝病的治疗主要集中于病因治疗,如抗病毒治疗或戒酒。虽然有证据表明病因治疗后肝纤维化会消退,但这是否能逆转晚期和严重的肝纤维化仍有待商榷。研究预防和逆转肝纤维化的有效治疗策略至关重要。
前沿科研成果:具有抑制纤维化和活性氧累积功能的四面体框架核酸-绿原酸复合物
绿原酸(CGA)是咖啡中一种重要的膳食多酚,因其抗氧化和抗癌活性而闻名于世,研究表明它对葡萄糖和脂质代谢以及心血管疾病具有积极的调节作用。此外,CGA 还能抑制大鼠肝纤维化。然而,CGA 在体内的吸收和生物利用率受到限制。通过口服进入血液循环,胃肠道上皮细胞仅能吸收三分之一的绿原酸,并在血液循环中迅速代谢。由于亲水性使其难以通过脂膜,因此大剂量的 CGA 已成为主要的治疗选择。然而,目前还没有研究确定大剂量 CGA 在体内是否能确保长期安全性。由于 CGA 的药代动力学不明确、长期毒性不明以及跨膜效率差,因此很难将其成功用作药物制剂。
四面体框架核酸(tFNAs)是一种新型三维核酸纳米材料,已被证明具有良好的生物相容性和药物递送性,能有效地将多种治疗单体(包括小分子药物、siRNA、microRNA 和多肽)带入细胞。研究还表明,tFNA 可抑制肺和皮肤纤维化过程中的上皮-间质转化,并具有一定的抗炎和抗氧化功能。基于上述研究,考虑到 tFNAs 的可运输性和功能性,本技术团队选择tFNA作为载体以克服 CGA 的固有缺陷,提高CGA的生物利用度,减轻大剂量药物应用带来的肝肾负担,并发挥tFNA与CGA在抗纤维化和抗氧化方面的协同作用,增强复合物对纤维生成的抑制作用。
研究方法:
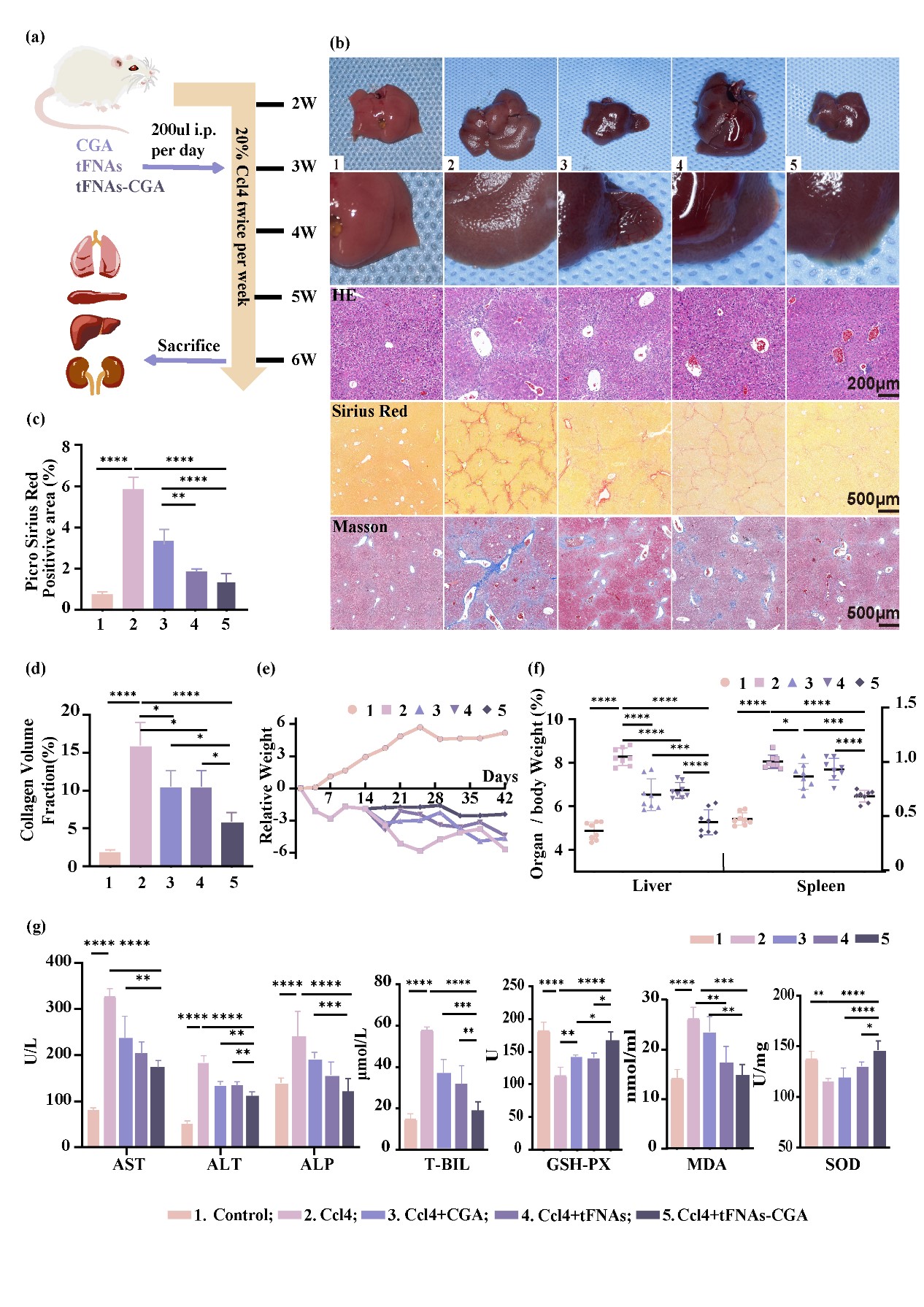
采用紫外分光光度计、TEM、和PAGE等方法鉴定tFNA-CGA的合成;共聚焦显微镜和流式细胞术检测tFNA-CGA进入肝星状细胞的能力;流式细胞术检测tFNA-CGA对肝形状细胞在TGF-β刺激下ROS产生情况;qPCR、WB检测tFNA-CGA对肝星状细胞相关基因和蛋白的调控。动物实验(四氯化碳构建肝纤维化模型)检测tFNA-CGA对小鼠肝纤维化的治疗作用。
实验结果:
本技术团队首次选用四面体框架核酸纳米颗粒作为载体,将多酚单体绿原酸输送到受伤的肝脏。这种递送系统提高了绿原酸的生物利用度和稳定性,为其抗纤维化和抗氧化作用奠定了基础。本技术团队研究结果表明,这种给药方法可以通过下调Smad2/3磷酸化,限制细胞外基质的合成,减轻肝纤维化,大幅改善小鼠肝纤维化表现,恢复正常肝功能;此外,该给药系统还可以通过上调Nrf2促进活性氧消耗,调节氧化应激,减轻小鼠多器官损伤。
研究结论:
我们的技术团队成功地构建了一种用于治疗 肝纤维化的绿原酸递送系统,高效的帮助绿原酸进入细胞,提高绿原酸的生物利用度,降低其体内应用的药物剂量。tFNA-CGA复合物通过抑制肝星状细胞的活化、抑制细胞外基质ECM产生和局部组织内活性氧的累积等方式显着减弱肝纤维化的发展,从而有效、高效地保护肝脏器官。
发表文献:ACS Materials Lett. 2023, 5, 4, 1153–1163,IF=11.4 DOI: 10.1021/acsmaterialslett.2c00839