DNA四面体在制备治疗肾损伤的药物中的用途
2024-06-26
tFNAs 主要通过缓解氧化应激和抑制细胞凋亡对细胞产生保护作用。tFNAs的这些特点极大地促进了肾脏富集,减少了AKI模型注射后的肾损伤。我们的研究结果表明, tFNAs 具有优异的抗氧化效率、结构稳定性、肾脏优先富集性和良好的生物相容性,是一类用于 AKI 治疗的新型抗氧化纳米材料。
背景:
肾脏是人体排泄体内代谢废物的重要器官。机械外力和外源化合物(如:庆大霉素、造影剂、顺铂、脂多糖、甘油等)均可直接或间接损害肾小管上皮组织,导致肾损伤,严重威胁健康甚至生命。
对肾小管上皮组织的间接损害,指机械外力或外源化合物作用于机体内肾脏以外的组织器官,使血液中某些物质含量突然增加或产生了某些新物质(不包括机体所摄入药物本身),进而损害肾小管上皮组织。例如:横纹肌溶解症(rhabdomyolysis, RM)导致的急性肾损伤(acute kidney injury, AKI)。RM导致的AKI的病死率高达20%~50%,目前治疗手段尚不成熟。目前治疗肾损伤所采取的首选方法是连续性肾脏替代治疗(continuous renal replacement therapy,CRRT),即通过体外循环血液净化技术连续、缓慢清除水分和溶质。其疗效值得肯定,但介入时机、治疗模式和剂量仍存在争议。目前已发现的治疗肾损伤的药物屈指可数,且存在明显的副作用,导致其应用存在诸多限制。抗氧化剂通过减轻对受伤肾脏的氧化损伤,在肾损伤的发病机制中发挥着早期干预作用。开发安全有效的活性氧(ROS)清除剂用于急性肾损伤(AKI)治疗仍值得探索。
前沿科研成果:具有肾损伤治疗作用的四面体框架核酸
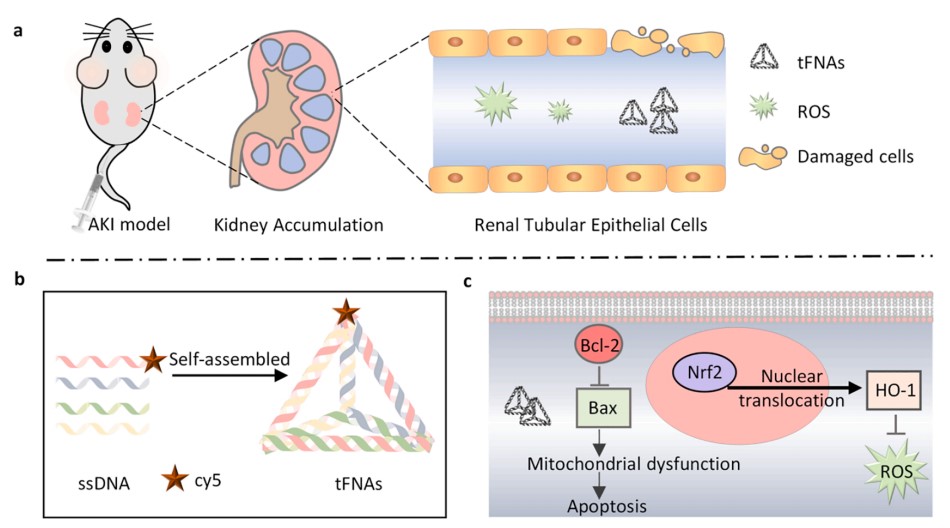
DNA四面体(tetrahedral DNA,TDN),又称四面体骨架核酸(tetrahedral framework nucleic acids, tFNAs)、四面体DNA纳米结构,是一种由4条单链DNA通过变性和复性,进而链间碱基互补配对形成的一种四面体结构,它易于合成,生物相容性高,通常用作某些药物的载体。
虽然 AKI 中活性氧(ROS)产生的确切机制尚未确定,但减少 ROS 的产生和减轻氧化损伤被认为是潜在的治疗方法。DNA 是一种天然存在的高分子,它不仅是遗传信息的载体,还是一种有序可控的框架核酸。在所有类型的 DNA 纳米结构中,四面体框架核酸(tFNA)受到越来越多的关注。研究发现,tFNA 在 RAW264.7 细胞系中具有显著的抗氧化作用。此特点使其有可能作为抗氧化剂用于 AKI 治疗。在此,我们提出了四面体框架核酸(tFNAs)作为治疗横纹肌溶解症所导致肾损伤(RM-AKI)的药物。
研究方法:
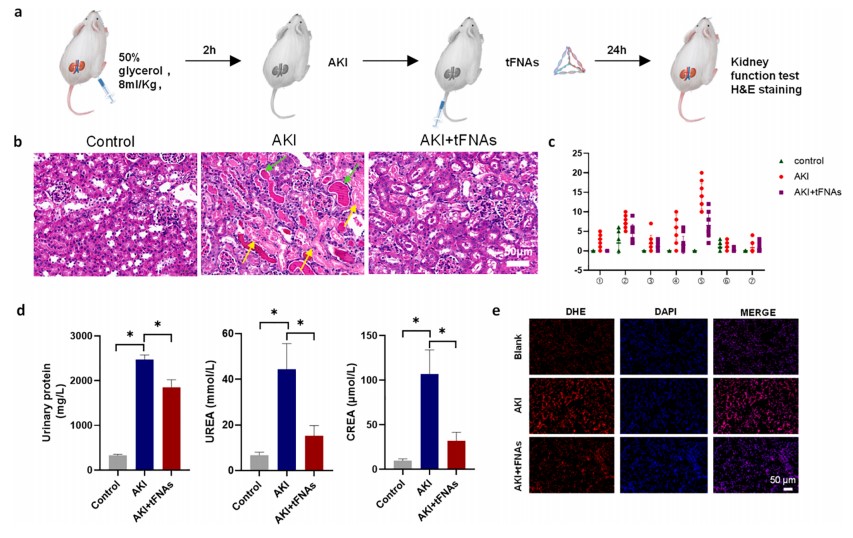
采用TEM、和PAGE等方法鉴定tFNA的合成;通过CCK-8、活性氧染色、qPCR等手段检测tFNA的抗氧化能力。通过流式细胞术,线粒体染色,qPCR等手段检测tFNA的抗凋亡能力。通过小动物活体成像和肾组织染色证明了tFNA的肾清除特性。通过动物模型,证明了tFNA对于RM-AKI治疗的有效性。
实验结果:
技术团队合成并鉴定了 tFNAs,并将其作为治疗 RM 诱导的 AKI 的药物。tFNAs 是由四条特殊设计的单链 DNA 通过碱基互补配对自组装而成的。tFNAs 在小鼠肾脏中显示出显著的靶向性和蓄积性。体外和体内实验均证明,tFNAs 在 AKI 模型中具有显著的治疗效果。tFNAs 可通过抑制细胞凋亡和降低氧化应激显著缓解肾损伤。在分子生物学方面,tFNAs 能上调促存活的 Bcl-2,下调促凋亡的 Bax,并减少线粒体功能障碍。Nrf2/HO-1 轴参与了 tFNAs 缓解氧化应激的过程。
研究结论:
tFNAs 主要通过缓解氧化应激和抑制细胞凋亡对细胞产生保护作用。tFNAs的这些特点极大地促进了肾脏富集,减少了AKI模型注射后的肾损伤。我们的研究结果表明, tFNAs 具有优异的抗氧化效率、结构稳定性、肾脏优先富集性和良好的生物相容性,是一类用于 AKI 治疗的新型抗氧化纳米材料。
发表文献:Chemical Engineering Journal. 2021, 127426, IF=13.3 DOI:10.1016/j.cej.2020.127426
![]() Tetrahedral framework nucleic acids act as antioxidants in acute kidney injury treatment
Tetrahedral framework nucleic acids act as antioxidants in acute kidney injury treatment