一种预防视网膜神经节细胞氧化应激和湿性黄斑病变的药物
2024-08-15
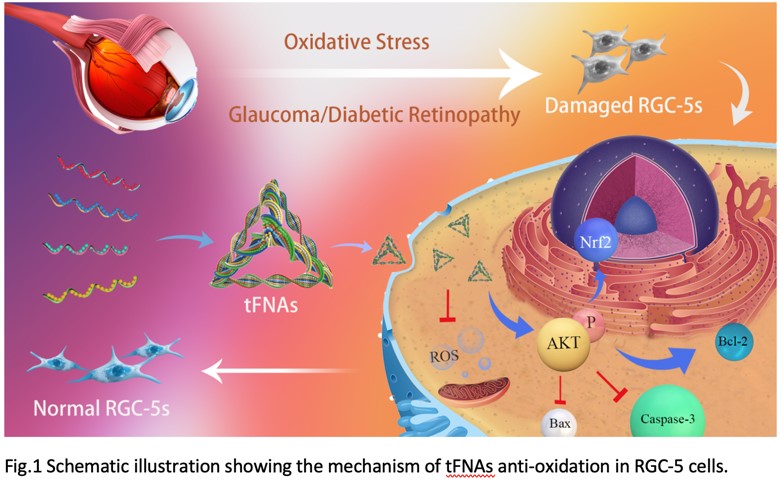
本发明的tFNA可以有效预防氧化应激和过氧化氢叔丁醇导致的细胞凋亡,进而对RGC-5细胞起到良好的保护作用。将tFNA用于制备预防视网膜神经节细胞氧化应激的药物,将有助于治疗包括青光眼等视网膜神经节细胞氧化应激导致的疾病,具有十分良好的应用前景。本发明的TDN-155组具有十分优良的视网膜修复功能,可用治疗湿性黄斑病变(包括湿性年龄相关性黄斑病变)。
背景:
氧化应激(Oxidative Stress,OS)是指体内氧化与抗氧化作用失衡的一种状态,倾向于氧化,导致中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量氧化中间产物。氧化应激是由自由基在体内产生的一种负面作用,并被认为是导致衰老和疾病的一个重要因素。
视网膜神经节细胞是位于视网膜最内层的细胞,其主要作用是接受视锥视杆细胞传导到双极细胞的电冲动,并将电冲动传递至视神经以产生视觉。视网膜神经节细胞的氧化应激参与了许多疾病的病理过程,包括青光眼,糖尿病、年龄相关性黄斑病变,视神经损伤等。当视网膜神经节细胞因为氧化应激受损时,视力必然会因此受到巨大的影响,轻则视野缺失,重则失明。
在临床上针对视网膜神经节细胞的氧化应激的预防与治疗尚且无药物可以使用。原因是视网膜神经节细胞是终末分化的神经细胞,再生能力很差。只有在疾病早期的时候预防,预防的方法只有根据相关疾病的病因进行预防。例如对于控制眼压后继续视网膜神经节细胞凋亡的青光眼患者,继续控制眼压。对持续性视野丧失的糖尿病患者,继续控制血糖。而很少针对视网膜神经节细胞进行保护。
作为近几年的研究热点,视网膜神经节细胞的保护有许多方案,包括查尔酮类似物,干细胞共培养等等,但都尚且停留在实验阶段,而未进入临床实验。
查尔酮类似物由于未有类似药物上市,其副作用尚且未知。干细胞共培养技术则过于昂贵且在临床上可操作性差,因为视网膜神病变给药一般是玻璃体注射,直接在玻璃体内注射细胞,玻璃体内的环境能否让细胞存活还是未知数。
湿性黄斑病变,也称为渗出性或新生血管性黄斑变性,多发生于老年人群,对应的疾病称为湿性年龄相关性黄斑病变(湿性AMD)。是玻璃膜疣等引起的Bruch膜损害,能诱发脉络膜的毛细血管向外层长出新生血管,可破坏脉络膜毛细血管、Bruch膜、RPE和光感受器细胞,引起严重的视力丧失。湿性黄斑病变目前只能通过注射抗血管生成的药物,以及玻璃体、黄斑部手术来治疗,价格昂贵,流程复杂。
前沿科研成果:DNA四面体和miR-155在制备预防或治疗湿性年龄相关性黄斑病变的药物中的用途。
miRNA是长度约为22个核苷酸的非编码RNA,研究表明,miRNA在OA发生、发展过程中具有重要的作用。其中,miRNA-124是一种在软骨组织中特异性表达的miRNA,对软骨发育、稳态维持及损伤修复起重要调控作用。但是,裸露的miRNA稳定性差、无法自主入胞、特异性差及治疗效力低等不足严重限制了其开发与应用。因此,开发能够有效递送miRNA-155至眼底,并避免脱靶效应的运载体系是亟待解决的科学问题。
DNA四面体又称四面体框架核酸(tetrahedral framework nucleic acid, tFNA)、四面体DNA纳米结构,是一种由4条单链DNA通过变性和复性,进而链间碱基互补配对形成的一种四面体结构,它易于合成,生物相容性高,通常用作某些药物的载体。
miR-155是一种保守的microRNA,参与体内免疫调节。免疫细胞内miR-155下调会引起免疫系统衰减。
目前尚未见DNA四面体或miR-155被用于预防视网膜神经节细胞氧化应激或湿性AMD的报道。
研究方法:
采用AFM、TEM、和PAGE等方法鉴定T-155 的合成;共聚焦显微镜和流式细胞术检测T-155进入视网膜神经节细胞的能力;CCK8和流式细胞术检测T3对视网膜神经节细胞凋亡及ROS产生情况;qPCR、WB检测T-155对视网膜神经节细胞相关基因和蛋白的调控。
实验结果:
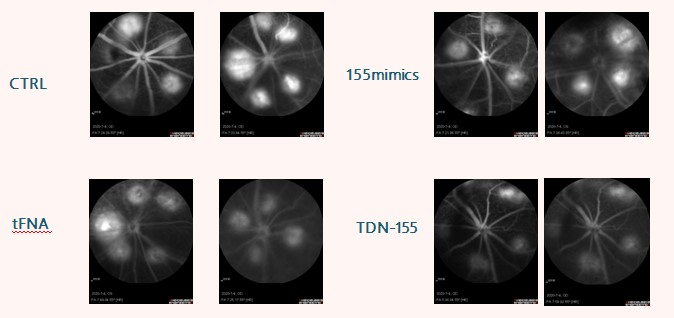
tFNA可以有效减少过氧基叔丁醇对RGC-5细胞的氧化应激损伤,降低炎症蛋白及凋亡蛋白的表达。此外,T-155可以有效抑制巨噬细胞向M1型极化,减少眼底新生血管的形成,并缓解激光造模后小鼠的视网膜病变。
研究结论:
本发明的tFNA可以有效预防氧化应激和过氧化氢叔丁醇导致的细胞凋亡,进而对RGC-5细胞起到良好的保护作用。将tFNA用于制备预防视网膜神经节细胞氧化应激的药物,将有助于治疗包括青光眼等视网膜神经节细胞氧化应激导致的疾病,具有十分良好的应用前景。本发明的TDN-155组具有十分优良的视网膜修复功能,可用治疗湿性黄斑病变(包括湿性年龄相关性黄斑病变)
发表文献:Bioact. Mater. 2021, 35310341 ,IF=18 DOI: 10.1016/j.bioactmat.2021.11.031.