一种治疗视神经疾病的复合物及其制备方法和用途
2024-08-15
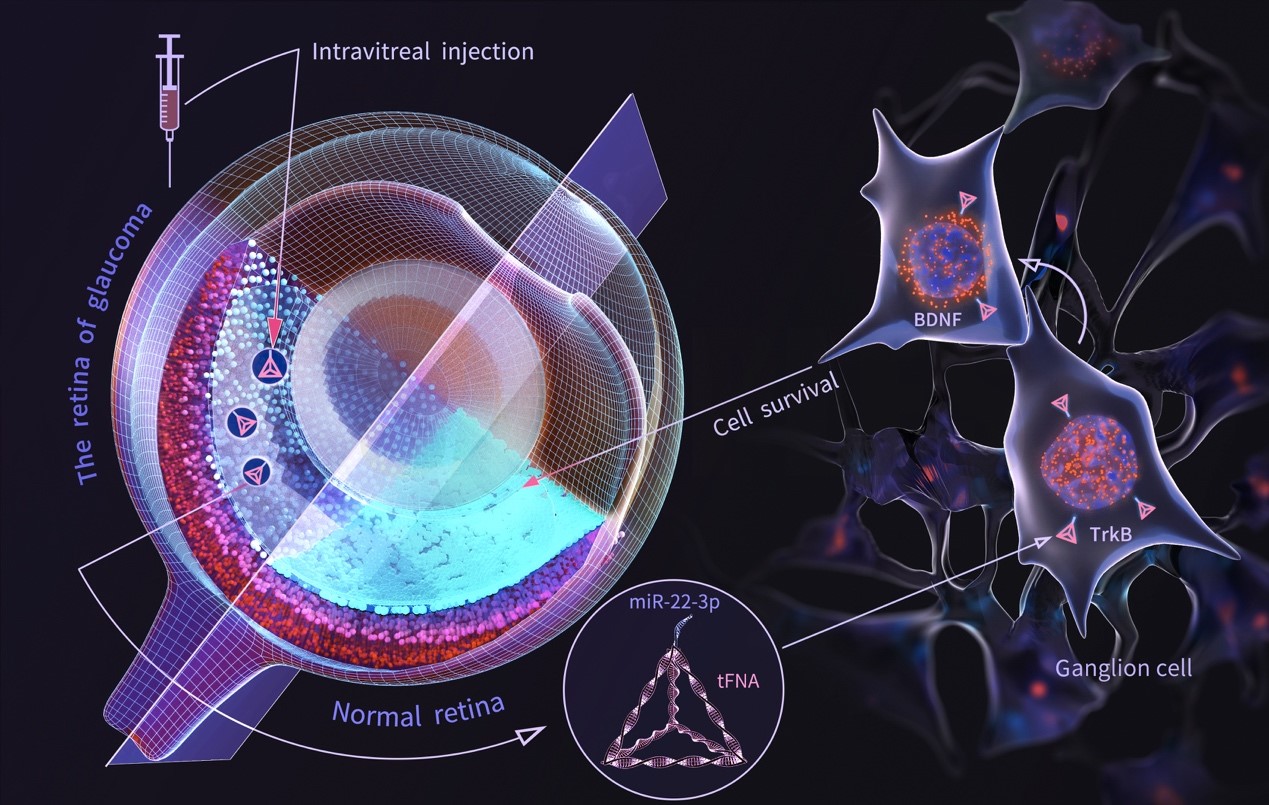
视神经保护是二十一世纪青光眼治疗的重要挑战之一,迫切需要相关治疗措施来减少或逆转这类渐进性视神经退行性改变。MicroRNA(miRNA)已成为基因表达的重要调节因子。研究表明,这些非编码RNA可能直接或间接涉及青光眼的发病机制。而miRNA-22-3p(miR-22)已被证明对神经退行性疾病,如阿尔茨海默病和亨廷顿病(HD)具有一定的神经保护作用,其相应的DNA序列也是预测青光眼的靶基因之一。技术团队证实tFNAs可以有效地将miR-22转移到受损的视网膜神经元中,从而对青光眼产生神经保护作用。我们的技术团队成功建立了一种简单但有效的与青光眼治疗相关的 microRNA 递送系统,这可能是未来治疗这种视神经退行性疾病的一种有前途的神经保护剂。
背景:
青光眼是世界首位的不可逆性致盲眼病,其特点是进行性视网膜神经节细胞(RGCs)丢失和轴突损伤。截至2020年,全球已有近8000万的青光眼患者。目前青光眼的主要治疗方法主要是通过药物或手术降低眼压以减缓对视神经的损害,然而单纯降低眼压并不能完全有效地阻止或逆转RGCs死亡所引起的视神经损害。部分青光眼患者眼压得到控制后,RGCs损害仍然持续进展,如不采取有效的治疗,视力可能完全丧失。因此,视神经保护是二十一世纪青光眼治疗的重要挑战之一,迫切需要相关治疗措施来减少或逆转这类渐进性视神经退行性改变。
前沿科研成果:具有促进视神经功能保护的四面体框架核酸-microRNA22复合物
MicroRNA(miRNA)已成为基因表达的重要调节因子。研究表明,这些非编码RNA可能直接或间接涉及青光眼的发病机制。而miRNA-22-3p(miR-22)已被证明对神经退行性疾病,如阿尔茨海默病和亨廷顿病(HD)具有一定的神经保护作用,其相应的DNA序列也是预测青光眼的靶基因之一。但是,裸露的miRNA稳定性差、无法自主入胞、特异性差及治疗效力低等不足严重限制了其开发与应用。因此,开发能够有效递送miRNA22至视网膜,并避免脱靶效应的运载体系是亟待解决的科学问题。
DNA四面体又称四面体框架核酸(tetrahedral framework nucleic acids, tFNAs)、四面体DNA纳米结构,是一种由4条单链DNA通过变性和复性,进而链间碱基互补配对形成的一种四面体结构,它易于合成,生物相容性高,通常用作某些药物的载体。相较于传统的病毒、阳离子或脂质体类载体而言,tFNA具有常规miRNA转染复合物不具备的优势。tFNA具有促进神经干细胞增殖、分化和/或迁移以及优异的抗炎抗氧化等作用。
基于此,我们的技术团队构建了搭载miR-22的tFNA复合物(tFNA-miR22),用于治疗青光眼引起的视神经损伤。通过序列延长法将miRNA-22搭载在tFNA外骨架其中之一的顶点上,既保留了TFNA空间结构及自身特性,同时赋予miRNA-22的功能特性,有助于在神经退行性疾病治疗中协同增效,使治疗作用最大化。
研究方法:
通过将载体和microRNA-22-3p(miR-22)连接到tFNA上进行修饰,合成新型DNA纳米复合物(tFNA-miR22)。并进一步采用AFM、TEM、和PAGE等方法鉴定tFNAs-miR22的合成;共聚焦显微镜和流式细胞术检测tFNAs-miR22进入视网膜神经节细胞的能力;CCK8和流式细胞术检测tFNAs-miR22对视网膜神经节细胞抗凋亡促进细胞增殖的能力;qPCR、WB检测tFNAs-miR22对视网膜神经节细胞相关基因和蛋白的调控。
实验结果:
技术团队证实tFNAs可以有效地将miR-22转移到受损的视网膜神经元中,从而对青光眼产生神经保护作用。更有趣的是,tFNA和miR-22之间显示出一定的协同作用。 tFNAs-miR22可以选择性激活酪氨酸激酶受体B(TrkB)并调节TrkB-脑源性生长因子(BDNF)信号通路,以恢复N-甲基-D-天冬氨酸(NMDA)诱导的模型中BDNF的表达 体内和体外青光眼,从而对视网膜神经元发挥神经保护作用。
研究结论:
我们的技术团队成功建立了一种简单但有效的与青光眼治疗相关的 microRNA 递送系统,这可能是未来治疗这种视神经退行性疾病的一种有前途的神经保护剂。
发表文献:Advanced Functional Materials, 2021, 31(36): 2104141. IF:19,DOI:https://doi.org/10.1002/adfm.202104141