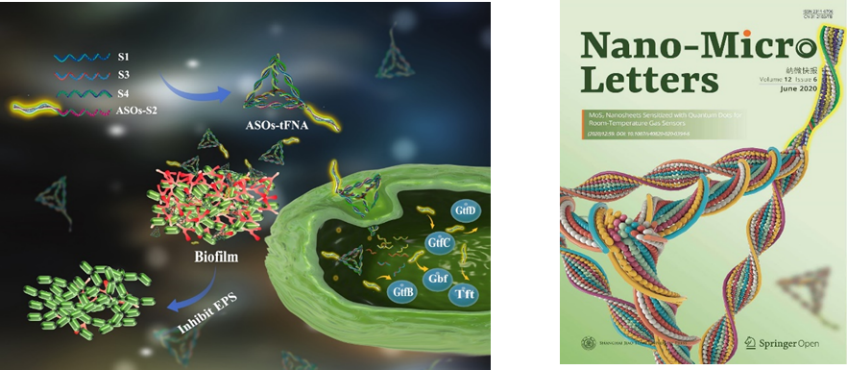
一种抑制细菌生物膜生长的DNA四面体复合物
2024-06-26
背景:
细菌生物被膜(或称细菌生物膜 Bacterial biofilm,BF),是指细菌粘附于接触表面,分泌多糖基质、纤维蛋白、脂质蛋白等,将其自身包绕其中而形成的大量细菌聚集膜样物。
生理条件下,与浮游细菌相比,BF 细菌对抗生素的耐药性可提高 500-5000 倍,其原因在于:首先,由于生物膜环境中营养物和空间的竞争,生物膜中的细菌生长和增殖,代谢率降低。其次,EPS(胞外聚合物)基质中的蛋白质和多糖成分可以防止和延迟抗生素渗透到生物膜中,给予位于基质深处的成熟细胞更多时间形成抗性。 第三,个体细菌具有抗性并产生抗生素抗性因子,从而导致整个生物膜群落的抗性;它被称为被动抗性,抗性相关基因可以通过侧向基因转移在细菌之间共享,这是一种在生物膜中不同菌株之间交换基因的机制。
BF内细菌并非随意堆砌,而是相互协调,构成一个具有高度分化结构的群体。除了对抗生素的耐药性提高以外,BF相比浮游细菌适应环境的能力(抗宿主免疫能力、耐酸性、抗饥饿性等等能力等等)全面提高,还具有更高的毒力。
微生物生物膜形成现在被认为是许多局部慢性感染的主要毒力因子。例如,心脏,肺组织,皮肤,口腔等。由于生物膜具有自我保护能力和强毒性,传统的治疗方法(如机械清创,抗生素,生物膜驱逐剂)无法提供足够的治疗效果,因此对抗生物膜感染的关键是抑制生物膜的形成。
前沿科研成果:能抑制细菌生物膜生长的多重靶向DNA四面体复合物
生物膜的形成是一个动态过程,其中细菌在早期定植和聚集阶段分泌大量细胞外多糖。因此,EPS相关基因和蛋白质已成为早期干预生物膜形成的重要目标。我们技术团队选择了VicRK信号转导系统调节的胞外多糖(EPS)相关的多种基因(gtfCBD, gbpB, ,ftf)作为目标靶点,希望通过模拟VicRK信号转导系统的作用机制,设计出了具有多重靶向性的反义寡核苷酸复合序列,赋予了框架核酸载体系统的多重靶向性。因此,技术团队针对这些目标基因共有的启动子保守区域设计了一段反义寡核苷酸混合序列,并修饰在四面体框架核酸(tFNA)的顶点上,以此成功设计并合成了一种具有多重靶向型的反义寡核苷酸递送系统(ASOs-tFNAs)。AOSs-tFNAs可以自由穿透变异链球菌的细胞壁,并携带反义寡核苷酸到特定基因,抑制靶基因的表达。同时证明了AOSs-tFNAs可以有效模拟变异链球菌生物膜中Vick蛋白的作用,能够同时靶向与EPS合成相关的多种基因,以达到抑制EPS合成的效果,提出了一种对抗细菌生物膜早期感染的新思路。 这是首次提出将框架核酸载体系统应用于细菌生物膜,并能够高效性的干预细菌生物膜的早期形成。该研究证明了一种具有多靶点抑制作用的新型核酸纳米载体系统(ASOs-tFNA),在治疗生物膜引起的慢性感染中具有巨大潜力。
研究方法:
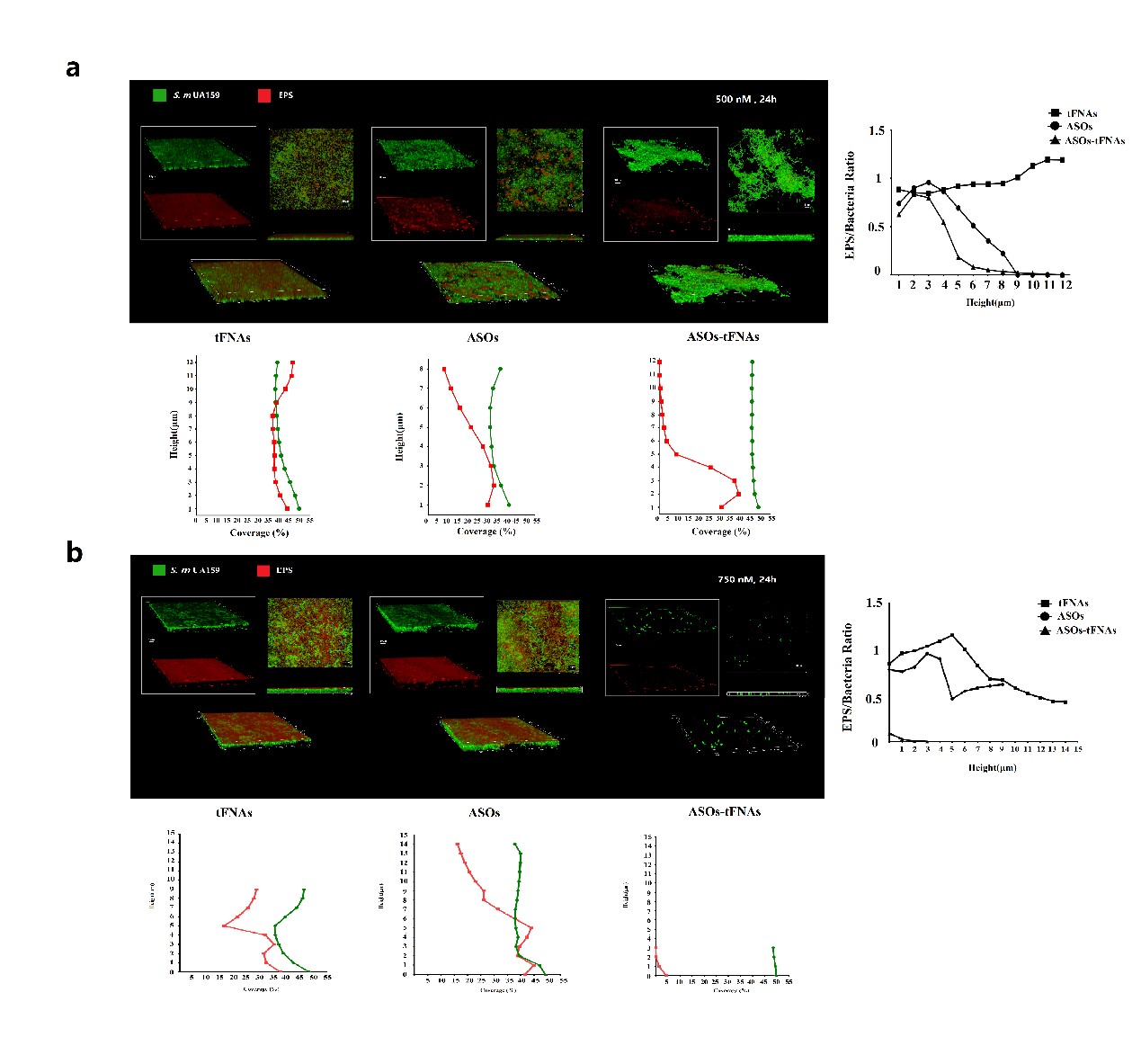
采用AFM、TEM、和PAGE等方法鉴定ASO-tFNAs的合成;流式细胞术检测ASO-tFNAs进入变异链球菌的能力;共聚焦显微镜、扫描电镜及结晶紫染色检测ASO-tFNAs对细菌生物膜形成的抑制作用;qPCR检测ASO-tFNAs的多重靶向性及目标基因(gtfBCD,gbpB,ftf)的调控。
实验结果:
技术团队通过模拟VicRK信号转导系统的作用机制设计出了具有多重靶向性的反义寡核苷酸复合序列,并开发了顶点型的tFNA递送系统递送靶向多种基因的反义寡核苷酸,它可以轻松的进入细菌细胞并发挥功能。这种基于VicK蛋白结合位点的保守区域设计的具有多个靶标的反义寡核苷酸序列,一旦被tFNA输送到细菌细胞内,它们会显着降低胞外多糖(EPS)合成和生物膜厚度。与现有方法相比,该系统非常有效,能同时减少了所有目标基因(gtfBCD,gbpB,ftf)的表达。
研究结论:
我们的技术团队成功构建了一种新颖有效的tFNA 递送系统,用于递送AOS。 不仅验证了该递送系统的稳定性和低毒性,且验证了AOSs-tFNA可以自由穿过穿透变异链球菌的细胞壁。 它们可以携带反义寡核苷酸到特定基因,抑制靶基因的表达。通过选择保守区域作为靶点还使其为、具有多种靶向性质,使得递送系统更有效。该系统的作用机制是通过抑制EPS的合成并抑制其在生物膜早期的形成和毒力。
发表文献:Nano-Micro Letters. 2020,12:74 (封面文章),IF 26.6 DOI:10.1007/s40820-020-0409-3